酸化鉄と塩酸の気体反応
酸化鉄に塩酸を加えても気体が発生しない理由
鉄を塩酸に加えると水素ガスが発生しますが、酸化鉄に塩酸を加えても気体は発生しません。この違いは鉄と酸化鉄の化学的性質の違いによるものです。
参考)https://www.fdtext.com/dp/r2k/sr2_k7_sanka_02.pdf
鉄は金属であり、塩酸と反応すると以下の化学反応式で表される反応が起こります。
参考)塩酸に鉄を加えた時の化学反応式を教えてください。
Fe + 2HCl → FeCl₂ + H₂↑
この反応では、鉄(Fe)が塩酸(HCl)と反応して塩化鉄(FeCl₂)と水素ガス(H₂)を生成します。水素ガスが泡となって発生するため、実験では気体の発生を目で確認できます。
参考)私の実践・私の工夫(理科)「水よう液の性質」~水よう液と金属…
youtube
一方、酸化鉄は既に酸素と結合した状態であり、鉄とは全く異なる物質です。酸化鉄を塩酸に入れても、塩素(Cl)は酸素(O)よりも電気陰性度が低いため、酸素と置き換わることができません。そのため、酸化鉄は塩酸と反応せず、気体も発生しないのです。
参考)スチールウールに塩酸かけると水素が発生するのに - Clea…
スチールウールを空気中で燃やすと酸化鉄ができますが、この酸化鉄に塩酸を加えても反応は起こりません。この性質の違いは、中学校の理科実験でも重要な観察ポイントとなっています。
参考)https://www.osaka-c.ed.jp/category/plan/pdf/13_01_B_02_004_01a.pdf
鉄と塩酸の反応で発生する水素ガスの性質
鉄に塩酸を加えると発生する水素ガスには、いくつかの特徴的な性質があります。水素ガスは無色無臭の気体ですが、実験では花火の燃えた後のような独特のにおいがすることがあります。これは不純物による影響です。youtube
参考)【中1理科】「水素の作り方・集め方」
水素ガスの発生を確認する実験では、試験管に発生した気体を集めて火を近づけると、「ポン」という小さな爆発音がします。これは水素の燃焼反応によるものです。
化学反応式:2H₂ + O₂ → 2H₂O
実験中は試験管の底を指で触ると温度上昇を感じることができます。これは鉄と塩酸の反応が発熱反応であることを示しています。
参考)https://www.mext.go.jp/component/a_menu/education/micro_detail/__icsFiles/afieldfile/2012/01/12/1304649_25_1.pdf
塩酸の濃度によって反応速度が変わります。9%の塩酸を使用する場合、塩酸10mLあたり鉄(スチールウール)300mgを入れると、上澄み液全体で約1gの反応物(塩化鉄)が得られます。濃度が3%では金属が溶け残り、15%では反応が激しくなり危険なため、5%から9%が実験に適切な濃度とされています。
参考)https://kawasaki-edu.jp/9/2kenkyukai/index.cfm/7,405,c,html/405/2020.benrichou.ensan.pdf
実験では安全眼鏡を着用し、十分な換気を行うことが重要です。塩化水素の刺激臭のある有毒な気体が少量発生するため、直接吸い込まないよう注意が必要です。
参考)https://www.shinko-keirin.co.jp/keirinkan/rika/jikken/pdf/6_007.pdf
酸化鉄の種類と化学式による分類
酸化鉄には3種類の主要な形態があり、それぞれ異なる化学式と性質を持っています。これらは鉄イオンの種類と酸素イオンの組み合わせによって決まります。
参考)酸化鉄 - Wikipedia
鉄イオンには「Fe²⁺(鉄(Ⅱ)イオン)」と「Fe³⁺(鉄(Ⅲ)イオン)」の2種類があり、酸素イオン「O²⁻」と3通りの組み合わせでくっつくため、3種類の酸化鉄ができます。
参考)酸化鉄(サビ)の種類や色についてわかりやすく解説!|かめのこ…
| 化学式 | 名称 | 別名 | 鉱物名 | 色・特徴 |
|---|---|---|---|---|
| FeO | 酸化鉄(II) | 酸化第一鉄 | ウスタイト | 黒色粉末、不安定 |
| Fe₃O₄ | 酸化鉄(II,III) | 四酸化三鉄 | 磁鉄鉱(マグネタイト) | 黒色、磁性あり、黒錆 |
| Fe₂O₃ | 酸化鉄(III) | 酸化第二鉄 | 赤鉄鉱(ヘマタイト) | 赤褐色、赤錆 |
酸化鉄(II)の生成式は以下の通りです。
Fe²⁺ + O²⁻ → FeO
酸化鉄(II,III)は「Fe²⁺」が1つと「Fe³⁺」が2つと「O²⁻」が4つの組み合わせで生成されます。
Fe²⁺ + 2Fe³⁺ + 4O²⁻ → Fe₃O₄
酸化鉄(III)は「Fe³⁺」が2つと「O²⁻」が3つの組み合わせです。
2Fe³⁺ + 3O²⁻ → Fe₂O₃
酸化鉄(II)は融点以上で金属鉄と酸化鉄(II,III)とに不均化を生じ、低温でも徐々に酸化鉄(II,III)に変化します。酸化鉄(III)は融点付近の高温(約1400℃あるいは真空中では250℃)で酸素を放出して酸化鉄(II,III)に変化する性質があります。
これらの酸化鉄は、音響やコンピューターの記録メディアとして利用されるほか、錆の主要成分でもあります。陶器の発色においても、これらの酸化鉄の種類によって異なる色合いを生み出すことができます。
酸化鉄と塩酸の反応における陶器製作への影響
陶器製作において酸化鉄は重要な着色剤として使用されますが、塩酸との反応性の違いを理解することは釉薬や顔料の化学的安定性を知る上で役立ちます。
酸化鉄は鉄と異なり塩酸に溶けにくい性質を持つため、陶器表面に施された酸化鉄系の釉薬や顔料は、酸性の環境下でも比較的安定しています。ただし、酸化鉄は完全に塩酸と反応しないわけではなく、長時間接触させると少しずつ溶解します。
参考)302 Found
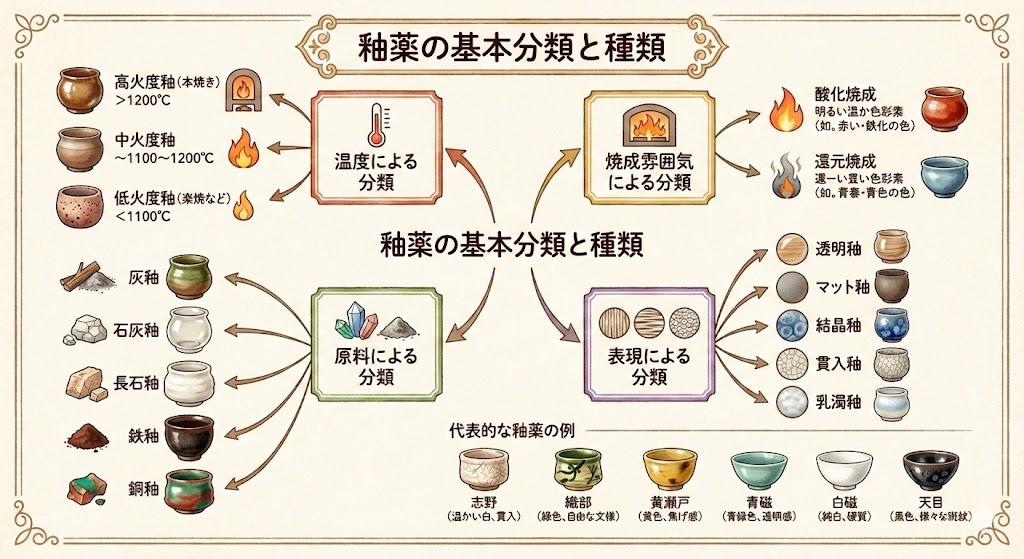
陶器の発色は、焼成時の温度と雰囲気(酸化焼成か還元焼成か)によって大きく変わります。酸化鉄(III)(Fe₂O₃)は赤褐色を呈し、酸化焼成では赤系統の発色を示します。一方、酸化鉄(II,III)(Fe₃O₄)は黒色で磁性を持ち、還元焼成では青緑色や黒色の発色を生み出します。
焼成による酸化鉄の変化:
- 酸化焼成(酸素が豊富):Fe₂O₃(赤褐色)が主体
- 還元焼成(酸素が少ない):Fe₃O₄やFeO(黒色・青緑色)が生成
高温(1400℃以上)では酸化鉄(III)が酸素を放出して酸化鉄(II,III)に変化するため、焼成温度の管理も発色に影響します。この化学的変化を理解することで、狙った色合いの陶器を製作する際の温度設定や雰囲気コントロールに活かせます。
また、酸化鉄は工業的にも重要な物質であり、乾燥状態やアルカリ条件下では表面安定化処理や錆防止剤として作用します。この性質は陶器の長期保存や耐久性にも関係しています。
塩化鉄の生成と工業的応用
鉄と塩酸の反応で生成される塩化鉄には、塩化鉄(II)(FeCl₂)と塩化鉄(III)(FeCl₃、塩化第二鉄とも呼ばれる)の2種類があります。
参考)世界と日本の工業用塩化第二鉄市場分析:規模、成長率、企業ラン…
鉄と塩酸の反応で生成される塩化鉄(II):
Fe + 2HCl → FeCl₂ + H₂↑
この反応では緑色を帯びた塩化鉄(II)水溶液が得られます。しかし、塩化鉄(II)は空気中の酸素によって酸化されやすく、時間が経つと赤褐色の塩化鉄(III)に変化します。
参考)CEJ
2FeCl₂ + Cl₂ → 2FeCl₃
塩化第二鉄(塩化鉄(III))は、強い酸性と腐食性を持つ物質で、産業界で幅広く利用されています。主な用途は以下の通りです。
参考)塩化第二鉄
工業用途:
- プリント基板(PCB)のエッチング剤
参考)塩化第二鉄市場 : 世界の市場規模と需要、シェア、トップ傾向…
- プラズマディスプレイやリードフレームのエッチング
- 下水処理場での汚泥凝集剤
- 工場排水処理における有機物・無機物の除去
- 上水処理における濁度成分の除去
- リン除去による富栄養化防止
参考)https://www.nittetsukou.co.jp/rdd/tech/tech_polyiron.html
水処理分野では、塩化第二鉄は凝集剤として廃水処理プラントで使用され、水中の不純物や固体粒子を効果的に除去します。また、重金属類の除去や硫化水素の発生抑制にも効果を発揮します。
電子機器製造においては、プリント基板のエッチング工程で銅を溶解させる薬剤として重要な役割を果たしています。半導体や液晶パネル製造における超純水製造プロセスにも応用が広がっています。
近年では、老朽化した下水処理施設の更新需要や工場排水規制の厳格化を背景に、高効率な水処理技術への要求が高まっており、塩化第二鉄の需要も増加しています。SDGsへの取り組みとして、水資源の有効活用や汚染物質排出量の削減が推進される中、塩化第二鉄は不可欠なソリューションとなっています。
塩化鉄(II)水溶液が赤褐色を呈する場合は、濃塩酸とスチールウールを加えて2時間後にろ過することで、緑色の塩化鉄(II)に再生できます。この方法は実験室での塩化鉄(II)の品質管理に活用されています。
また、フェノール類の検出には塩化鉄(III)水溶液が使用され、青から赤紫色の呈色反応を示します。これはフェノキシドイオンが鉄(III)イオンと錯イオンを形成するためです。youtube
参考)https://www.chart.co.jp/subject/rika/scnet/73/Snet73-3.pdf
酸化鉄 着色原料 鉄化合物 陶芸 粉末 100g