過マンガン酸カリウムの色変化
過マンガン酸カリウムの色変化メカニズム
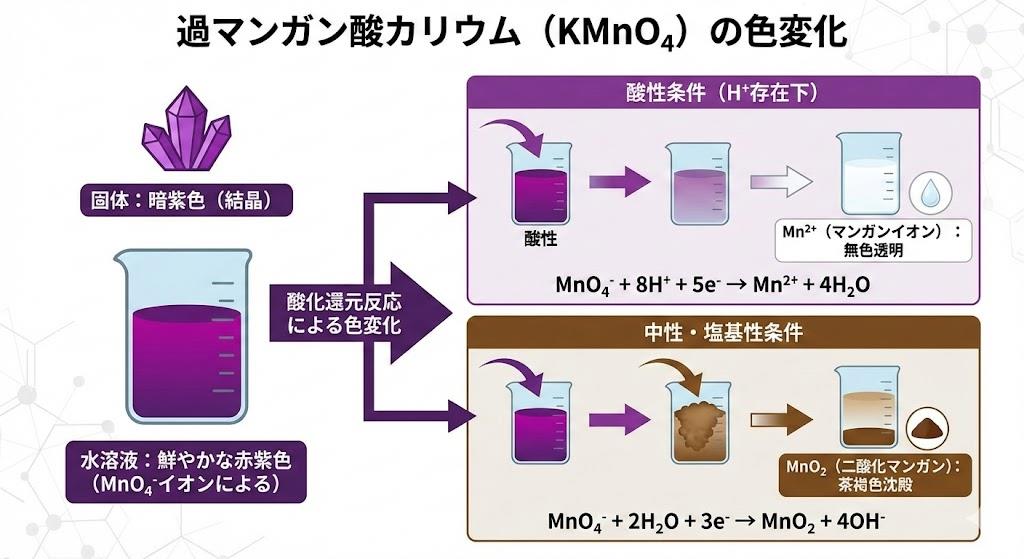
過マンガン酸カリウム(KMnO₄)の固体は黒紫色をしており、水に溶解すると赤紫色の溶液となります。この鮮やかな色は過マンガン酸イオン(MnO₄⁻)に由来し、マンガンの酸化数が+7価という高い状態にあることを示しています。水溶液中では過マンガン酸イオンが525nmと545nmの波長域の光(緑色光)を強く吸収するため、補色である赤紫色として観察されるのです。
酸化還元反応が起こると、過マンガン酸イオンは還元剤から電子を受け取り、マンガンの酸化数が+7価から+2価へと変化します。この時生成するMn²⁺イオンは非常に薄いピンク色ですが、濃度が低い場合はほぼ無色に見えます。硫酸酸性条件下では、過マンガン酸イオンは以下の半反応式に従って還元されます。
MnO₄⁻ + 8H⁺ + 5e⁻ → Mn²⁺ + 4H₂O
この反応により、赤紫色の溶液が無色透明に変化するため、目視で反応の終点を判定できるという大きな利点があります。
過マンガン酸カリウムと還元剤の反応例
硫酸酸性条件下で過マンガン酸カリウムと様々な還元剤を反応させると、明確な色変化が観察できます。代表的な例としてシュウ酸(H₂C₂O₄)との反応があり、この反応では過マンガン酸カリウムの赤紫色が徐々に消失していきます。
シュウ酸の半反応式は以下の通りです。
H₂C₂O₄ → 2CO₂ + 2H⁺ + 2e⁻
過マンガン酸イオンの半反応式と組み合わせると、全反応式は次のようになります。
2MnO₄⁻ + 5H₂C₂O₄ + 6H⁺ → 2Mn²⁺ + 10CO₂ + 8H₂O
反応初期は温度が低いため反応速度が遅く、過マンガン酸カリウムの赤紫色がしばらく残りますが、反応が進行し溶液温度が上昇すると、色の消失が加速されます。
硫酸鉄(II)との反応も頻繁に利用されます。Fe²⁺イオンがFe³⁺イオンに酸化される際、過マンガン酸イオンは還元されます。
5Fe²⁺ + MnO₄⁻ + 8H⁺ → 5Fe³⁺ + Mn²⁺ + 4H₂O
この反応では、青緑色のFe²⁺イオンが黄色のFe³⁺イオンに変化しつつ、過マンガン酸イオンの赤紫色が消失するため、複雑な色変化が観察されます。
過酸化水素(H₂O₂)も還元剤として働き、酸素を発生させながら過マンガン酸カリウムの色を消失させます。
2MnO₄⁻ + 5H₂O₂ + 6H⁺ → 2Mn²⁺ + 5O₂ + 8H₂O
この反応では気泡が発生するため、視覚的にも反応の進行を確認しやすい特徴があります。
過マンガン酸カリウムを用いた酸化還元滴定実験
酸化還元滴定は過マンガン酸カリウムの色変化を利用した定量分析法です。実験では、濃度既知の過マンガン酸カリウム溶液をビュレットに入れ、濃度未知の還元剤溶液が入ったコニカルビーカーに滴下します。
実験手順は以下の通りです。まず、還元剤溶液を硫酸酸性にします。これは反応を確実に進行させるためと、過マンガン酸イオンがMn²⁺まで完全に還元されるようにするためです。塩酸や硝酸は使用できません。塩酸を使用するとCl⁻イオンが過マンガン酸イオンに酸化されてしまい、硝酸を使用すると硝酸自体が酸化剤として働いてしまうからです。
次に、過マンガン酸カリウム溶液をビュレットの先端まで満たします。中和滴定と異なり、過マンガン酸カリウムは自身が指示薬の役割も果たすため、別途指示薬を加える必要はありません。
滴定を開始すると、最初は滴下した過マンガン酸カリウムの赤紫色がすぐに消失します。これは還元剤が過剰に存在しているためです。滴定を続けていくと、還元剤が消費されていくため、色の消失に時間がかかるようになります。還元剤が完全に消費された時点で、わずか1滴の過マンガン酸カリウムを加えただけで溶液全体が薄い赤紫色に変化します。この色が30秒以上持続した時点を終点とします。
シュウ酸を標準溶液として用いる場合、反応初期は温度が低いため反応が遅く進行します。そのため、シュウ酸溶液を60~70℃程度に加温してから滴定を行うのが一般的です。温度が高いと反応が速く進み、終点の判定がより正確になります。
過マンガン酸カリウムと鉱石中のマンガンの関係
過マンガン酸カリウムの原料であるマンガンは、様々な鉱石から採取されます。主要なマンガン鉱石には酸化マンガン鉱、炭酸塩マンガン鉱、珪酸塩マンガン鉱があり、それぞれ異なる化学組成を持っています。
酸化マンガン鉱の代表的なものは軟マンガン鉱(MnO₂)で、マンガン含有量は約63.2%です。ハウスマン鉱(Mn₃O₄)は約72.0%のマンガンを含み、クリプトメレン(K(Mn⁴⁺,Mn²⁺)₈O₁₆)は約59.8%のマンガンを含有しています。これらの鉱石は主に古生代から中生代の珪岩やチャート中に層状をなして産出します。
炭酸塩マンガン鉱の主要なものは菱マンガン鉱(MnCO₃)で、マンガン含有量は約47.8%です。この鉱石は通常脈状に産出し、閃亜鉛鉱や方鉛鉱を伴うことが多く、日本では北海道や東北地方のグリーンタフ地域に分布していました。
珪酸塩マンガン鉱にはテフロ石(Mn₂SiO₄)、バラ輝石(MnSiO₃)、ブラウン鉱(Mn²⁺Mn³⁺₆SiO₁₂)などがあり、マンガン含有量はそれぞれ約54.4%、約33.5%、約63.6%です。これらは接触変成帯や晶質珪岩中に層状に産出します。
マンガン鉱石から過マンガン酸カリウムを製造する工程では、まず二酸化マンガンを強塩基性条件下で酸化剤(塩素酸カリウムなど)と反応させてマンガン酸カリウム(K₂MnO₄)を生成します。
3MnO₂ + 6KOH + KClO₃ → 3K₂MnO₄ + KCl + 3H₂O
次に、マンガン酸イオンを酸性条件下で不均化反応させることで過マンガン酸カリウムが得られます。マンガン酸イオンは緑色ですが、酸性条件下では不安定になり、一部が過マンガン酸イオンに酸化され、一部が二酸化マンガンに還元されます。
3K₂MnO₄ + 2CO₂ → 2KMnO₄ + MnO₂ + 2K₂CO₃
このようにして得られた過マンガン酸カリウムは、酸化剤として酸化還元滴定だけでなく、水処理、殺菌、漂白、有機合成など幅広い用途に利用されています。日本では過去に多数のマンガン鉱山が稼働していましたが、1980年代以降はほぼすべて閉山し、現在は南アフリカ、オーストラリア、ガボン、中国などからの輸入に依存しています。
過マンガン酸カリウム色変化実験の注意点と応用
過マンガン酸カリウムを用いた実験では、いくつかの重要な注意点があります。まず、過マンガン酸カリウム溶液は光に対して不安定で、特に紫外線によって分解されやすい性質があります。そのため、溶液は褐色瓶に保存し、直射日光を避ける必要があります。分解すると二酸化マンガンが生成し、溶液中に黒褐色の沈殿が生じます。
また、過マンガン酸カリウム溶液は蒸留水中の微量の有機物によっても分解されるため、調製直後の溶液は正確な濃度を持ちません。そのため、使用前に必ずシュウ酸標準溶液などで標定を行い、正確な濃度を確定する必要があります。標定は定期的に繰り返すことが推奨されます。
硫酸酸性条件での実験では、硫酸の濃度も重要です。硫酸濃度が低すぎると、生成したMn²⁺が過マンガン酸イオンを分解してしまい、正確な測定ができなくなります。一般的には6mol/Lの硫酸を使用し、十分な酸性度を保つようにします。
過マンガン酸カリウムの強力な酸化作用は、環境分野でも応用されています。浄水処理では鉄イオンやマンガンイオンの除去、トリハロメタン生成の抑制に利用されています。過マンガン酸カリウムを添加すると、水中の鉄やマンガンが酸化されて不溶性の酸化物となり、沈殿除去が可能になります。同時に生成する二酸化マンガンが凝集剤として働くため、その後の凝集処理で使用する薬剤量を減少させることもできます。
下水処理では硫化水素やメルカプタンなどの悪臭物質の酸化分解に用いられます。処理工程の前段階で過マンガン酸カリウムを添加することで、臭気を効果的に低減できます。
さらに、フェノール系化合物の分解にも高い効果を示します。過マンガン酸カリウムはフェノールを迅速に酸化分解するため、内分泌撹乱化学物質(環境ホルモン)の処理にも応用が検討されています。塩素系酸化剤と比較して、有害な副生成物が少ないという利点もあります。
鉱石分析の分野では、鉄鉱石中の鉄の定量に過マンガン酸カリウムが利用されます。鉱石を塩酸で溶解してFe³⁺を得た後、還元剤で Fe²⁺に還元し、過マンガン酸カリウムで滴定することで鉄の含有量を正確に測定できます。この方法は「ラインハルト・ツィンメルマン法」として知られ、鉱石分析の標準的な手法となっています。
酸化還元滴定の詳細な実験方法と計算問題の解説(化学のグルメ)
酸化還元滴定の理論から実践まで、過マンガン酸カリウムを使った実験手順と計算方法を詳しく解説しています。
信州大学による酸化還元滴定の解説資料
大学レベルでの酸化還元滴定の理論と実験方法について、過マンガン酸カリウムと硫酸鉄の反応を中心に詳細に説明されています。
山口大学工学部学術資料展示館によるマンガン鉱石の解説
日本国内のマンガン鉱山の歴史とマンガン鉱石の種類、化学組成について詳細な情報が掲載されています。




