塩素酸カリウム酸化マンガンなぜ触媒として酸素が発生
塩素酸カリウムの熱分解における酸化マンガンの役割
塩素酸カリウム(KClO3)に酸化マンガン(Ⅳ)(MnO2)を加えて加熱すると、酸素が発生する反応が起こります。この反応の化学反応式は「2KClO3 → 2KCl + 3O2」となり、酸化マンガンは触媒として機能します。触媒とは、反応の速度を上げながら自身は変化しない物質のことで、酸化マンガンはこの反応において反応前後で質量が変化しません。過酸化水素水の分解反応でも同様に酸化マンガンが触媒として用いられ、どちらの反応も自己酸化還元反応の一種です。
参考)【高校化学】「酸素の製法」
酸化マンガンが触媒として働く理由は、電子のやり取りを仲介する中継点として機能するためです。塩素酸カリウムの分解では、酸化マンガンが複雑な電子移動のプロセスを促進し、活性化エネルギーを大幅に下げることで、低温でも反応が進行するようになります。触媒が存在しない場合、塩素酸カリウムは400℃で分解しますが、酸化マンガンを添加すると70℃程度でも効率的に反応が進みます。
参考)入試で役立つ化学 触媒について - 【公式】マンツーマン指導…
この反応は実験室で酸素を製造する際の標準的な方法として広く利用されています。固体同士の反応であるため加熱が必要ですが、過酸化水素水を用いる方法と比べて安全性が高く、大量の酸素を得ることができます。
参考)https://sekatsu-kagaku.sub.jp/inorganic-chemistry3.htm
塩素酸カリウム分解の二段階反応メカニズム
塩素酸カリウムの熱分解は、実際には二段階で進行する複雑な反応です。第一段階では、塩素酸カリウムが自己酸化還元反応により過塩素酸カリウム(KClO4)を生成します。この段階では、塩素酸カリウムが酸化剤と還元剤の両方として働き、「4KClO3 → 3KClO4 + KCl」という反応が起こります。
参考)無機化学 第19回 酸素
第二段階では、生成した過塩素酸カリウムが加熱により分解して酸素を放出します。この反応式は「KClO4 → KCl + 2O2」となり、二つの段階を合わせることで、最終的に「2KClO3 → 2KCl + 3O2」という全体の反応式が得られます。酸化マンガンの触媒作用により、これらの反応が連続的にスムーズに進行することで、効率的な酸素の発生が実現されます。
塩素酸カリウムは356℃で融解し、液体状態になると反応が加速します。この融解状態で木片などを投入すると、高濃度の酸素雰囲気により激しい燃焼反応が起こり、まばゆい光を発します。燃焼後の試験管には白い塩化カリウムの結晶が付着し、反応の進行を確認できます。
参考)輝く木片 ~塩素酸カリウムの熱分解~ - VCPteam’s…
酸化マンガン触媒の活性化エネルギー低下効果
触媒として機能する酸化マンガンの最も重要な役割は、反応の活性化エネルギーを低下させることです。活性化エネルギーとは、化学反応が起こるために必要な最低限のエネルギーのことで、この値が高いほど反応は進みにくくなります。酸化マンガンが存在することで、塩素酸カリウムの分解に必要なエネルギーが大幅に減少し、より低い温度でも反応が進行するようになります。
参考)【大学の有機化学】アルケンの主要な反応(求電子付加反応の立体…
不均一触媒である酸化マンガンは、その表面で反応が起こります。塩素酸カリウムの分子が酸化マンガンの表面に吸着すると、分子の結合が弱まり、分解しやすい状態になります。この表面での相互作用により、電子の移動がスムーズになり、自己酸化還元反応が効率的に進行します。反応後、生成物は触媒表面から離れ、酸化マンガンは元の状態に戻るため、繰り返し使用できます。
参考)塩素酸カリウムに酸化マンガン(IV)を加え加熱したら気体が発…
触媒である酸化マンガンに食塩を添加した混合物を用いると、分解反応の挙動がさらに変化することが知られています。示差熱分析(DTA)によると、酸素放出に対応する発熱ピークの位置や形状が変化し、反応機構に影響を与えることが確認されています。
参考)https://www.jstage.jst.go.jp/article/nikkashi1948/87/2/87_2_128/_pdf
塩素酸カリウム実験での安全性と注意事項
塩素酸カリウムを用いた酸素発生実験では、いくつかの重要な安全上の注意点があります。塩素酸カリウムは光で分解する性質があるため、褐色の瓶に密栓して保管するか、冷暗所に保管する必要があります。また、精製時には粗製塩素酸カリウムの熱飽和水溶液を約10分間沸騰させることで、不安定な不純物である亜塩素酸カリウムや次亜塩素酸カリウムを分解し、偶発的な発火を防ぐ処理が必要です。
参考)塩素酸カリウム - Wikipedia
実験装置の組み立てでは、適切な加熱方法と温度管理が重要です。塩素酸カリウムは固体であるため、酸化マンガンとの混合物を加熱する際には、均一な加熱を心がけ、局所的な過熱を避ける必要があります。過熱すると激しい反応が起こり、危険な状況を招く可能性があります。特に有機物との接触は避けるべきで、木片などの可燃物が混入すると予期せぬ激しい燃焼が発生する恐れがあります。
生成した酸素の捕集には、水上置換法が一般的に用いられます。酸素は水に溶けにくい性質があるため、水を満たした容器の中で気体を集めることができます。この方法により、純度の高い酸素を得ることが可能となります。実験後は、触媒として使用した酸化マンガンを適切に回収・保管することで、次回の実験でも再利用できます。
参考)【中1理科】「酸素の作り方・集め方」
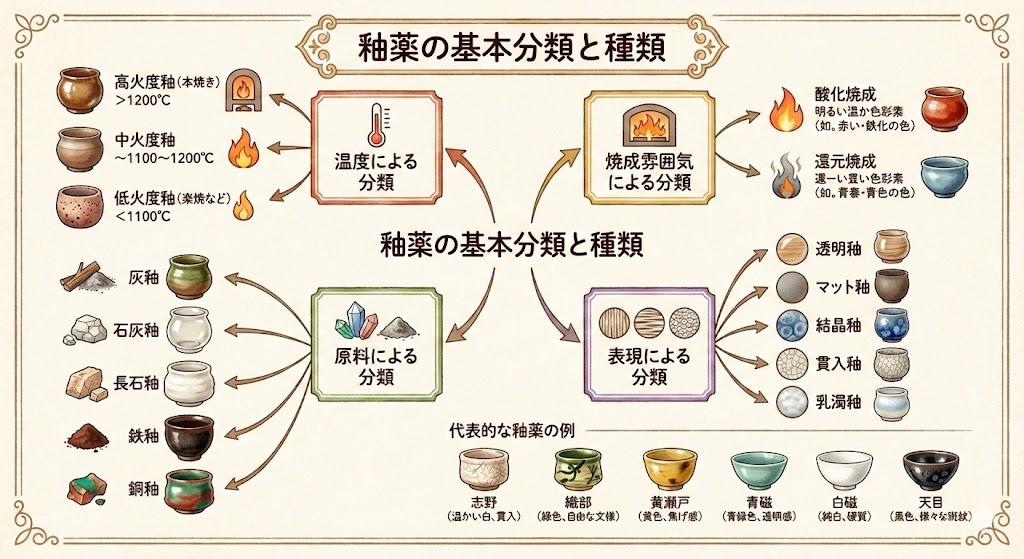
塩素酸カリウムと陶器製作における酸化反応の関連性
陶器や食器の製作過程においても、酸化反応は重要な役割を果たしています。窯の中で高温加熱される際、粘土に含まれる様々な化合物が酸化・還元反応を起こし、最終的な色味や質感が決定されます。特にマンガン化合物は、陶器の釉薬に含まれることで紫色や褐色の発色を生み出す着色剤として利用されています。
参考)除マンガンのメカニズム href="https://www.tohkemy.co.jp/technology/jyo_mangan/" target="_blank">https://www.tohkemy.co.jp/technology/jyo_mangan/amp;laquo; 株式会社トーケミ
マンガン及びその化合物は、工業分野でも幅広く活用されており、鉄鋼業などで大量に使用されています。除マンガンのプロセスでは、マンガンを酸化する自触媒反応が利用されており、次亜塩素酸ナトリウムなどの酸化剤により連続的にマンガンを除去できます。この自触媒反応のメカニズムは、塩素酸カリウムの分解における酸化マンガンの触媒作用と類似した原理に基づいています。
参考)https://www.env.go.jp/chemi/prtr/archive/guide_H23/3.pdf
陶芸愛好家の方々にとって、化学反応の理解は作品の品質向上に役立ちます。窯の温度管理や雰囲気(酸化焼成・還元焼成)の調整は、まさに化学反応をコントロールする作業であり、塩素酸カリウムの熱分解のような基礎的な化学知識が応用できる場面が多くあります。釉薬に含まれる金属酸化物の挙動を予測することで、より意図した色や質感の作品を生み出すことが可能になります。