酸化数と酸化還元
酸化数とは何か:化合物中の電子状態を知る指標
酸化数とは、物質中の各原子が単体の時と比べてどれだけ電子を失ったか、あるいは得たかを表す数値です。この概念は1938年に米国のウェンデル・ラティマーによって考案されました。酸化数を理解することで、複雑な化学反応においても、どの原子が酸化され、どの原子が還元されたのかを明確に判断できるようになります。
酸化数は正の値と負の値を取ります。正の値が大きいほど電子不足の状態(酸化状態)にあり、負の値が大きいほど電子過剰の状態(還元状態)にあることを示します。例えば、鉄イオンFe²⁺の酸化数は+2、酸化物イオンO²⁻の酸化数は-2となります。
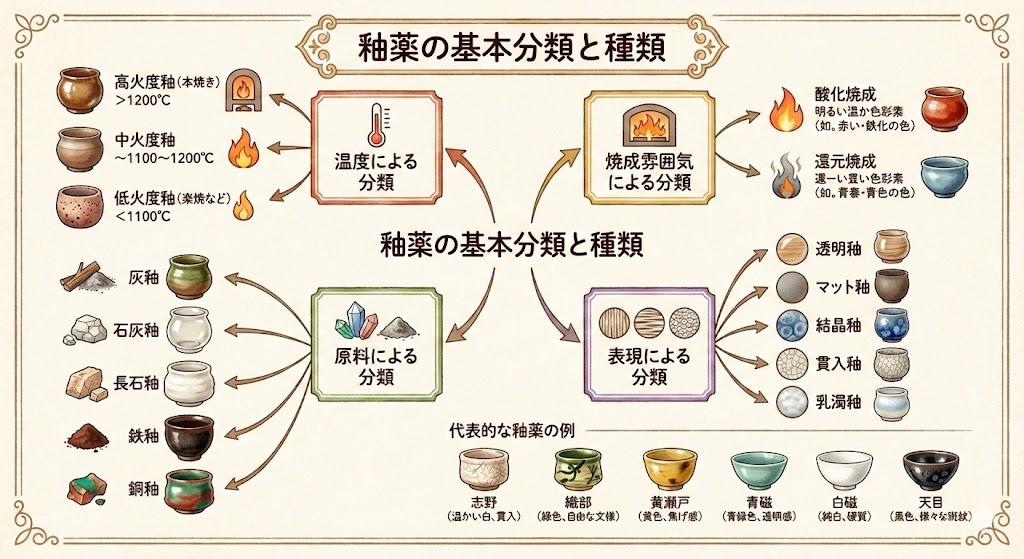
陶芸における釉薬の発色は、この酸化数の変化に大きく影響されます。同じ金属元素でも、酸化数が異なると全く違う色を呈するのです。例えば、銅は酸化数+1では赤色、酸化数+2では緑色や青色を示します。窯の焼成雰囲気(酸化焼成か還元焼成か)によって、金属イオンの酸化数が変化し、釉薬の最終的な色が決まるのです。
酸化数の求め方:化合物での計算ルール
酸化数を求めるには、いくつかの基本ルールがあります。まず、単体の酸化数は常に0です。Cu、O₂、H₂などの単体元素はすべて酸化数0となります。
化合物中では、以下のルールに従います。
- 水素Hの酸化数は通常+1(ただし金属の水素化物では-1)
- 酸素Oの酸化数は通常-2(ただし過酸化水素H₂O₂では-1)
- アルカリ金属(Na、Kなど)の酸化数は+1
- アルカリ土類金属(Mg、Caなど)の酸化数は+2
- ハロゲンの酸化数は-1
- 電荷をもたない化合物では、全ての原子の酸化数の総和は0
- イオンでは、全ての原子の酸化数の総和はイオンの電荷に等しい
例えば、硝酸HNO₃中の窒素Nの酸化数を求める場合、H=+1、O=-2として、(+1)+N+(-2)×3=0から、N=+5と計算できます。この計算方法を習得することで、複雑な化合物中の酸化数も正確に求められるようになります。
酸化還元と電子の受け渡し:酸化数変化の本質
酸化還元反応の本質は、原子間での電子の受け渡しです。物質が電子を失う反応を酸化、電子を得る反応を還元といいます。そして、この電子の授受を数値化したものが酸化数の変化なのです。
電子e⁻を失うと、マイナスの電荷が減るため、酸化数は増加します。逆に電子を得ると、酸化数は減少します。例えば、Fe²⁺がFe³⁺になる反応(Fe²⁺→Fe³⁺+e⁻)では、鉄は電子を1個失うため、酸化数は+2から+3へ増加しています。これは酸化反応です。
一方、MnO₄⁻がMn²⁺になる反応では、マンガンの酸化数は+7から+2へ減少しており、これは還元反応です。このように、酸化数の増減を見るだけで、その原子が酸化されたのか還元されたのかが一目瞭然になります。
酸化と還元は必ず同時に起こります。一方の物質が電子を失えば(酸化)、もう一方の物質がその電子を受け取る(還元)ためです。この関係を「酸化還元反応」と呼びます。陶器の焼成においても、釉薬中の金属イオンと窯内の雰囲気ガスとの間で、このような電子の受け渡しが絶えず行われているのです。
酸化数の増加と減少:判定方法と実例
酸化還元反応を判定する最も確実な方法は、酸化数の変化に注目することです。反応の前後で酸化数が増加した原子を含む物質は「酸化された」、酸化数が減少した原子を含む物質は「還元された」と判断します。
具体例として、銅と酸素の反応(2Cu + O₂ → 2CuO)を見てみましょう。
- 銅Cu:酸化数が0から+2へ増加 → 酸化された
- 酸素O:酸化数が0から-2へ減少 → 還元された
この反応では、銅が電子を失って酸化され、酸素が電子を得て還元されています。酸化数の増加量と減少量の総和は必ず等しくなります。銅2原子で酸化数が計4増加し、酸素2原子で酸化数が計4減少しており、電子の授受がバランスしていることが分かります。
陶芸の現場では、酸化焼成と還元焼成という言葉をよく耳にします。酸化焼成では窯内に酸素が十分にあるため、金属イオンは酸化数の高い状態(電子を失った状態)になりやすく、還元焼成では酸素が不足するため、金属イオンは酸化数の低い状態(電子を得た状態)になりやすいのです。この酸化数の違いが、釉薬の色の違いとして現れます。
陶器釉薬における酸化数:発色の科学的メカニズム
陶器や食器の美しい色彩は、釉薬に含まれる金属イオンの酸化数によって決まります。これは他の分野ではあまり注目されない、陶芸特有の酸化数の応用例です。
銅は酸化数によって劇的に色が変化する代表的な元素です。酸化銅(I)(Cu₂O、銅の酸化数+1)は赤色を呈し、辰砂釉や紅釉として珍重されます。一方、酸化銅(II)(CuO、銅の酸化数+2)は黒色で、還元雰囲気では美しい青緑色の釉薬になります。この色の違いは、銅イオンの電子配置の違いによるものです。
鉄もまた、酸化数によって異なる色を示します。酸化鉄(II)(FeO、鉄の酸化数+2)は青緑色、酸化鉄(III)(Fe₂O₃、鉄の酸化数+3)は赤褐色を呈します。織部釉の深い緑色は、銅と鉄の複雑な酸化還元状態によって生み出されています。
マンガンは、酸化数+2で淡いピンク色、酸化数+3で褐色、酸化数+4で黒色を示します。このように、同じ元素でも酸化数が変わることで、まったく異なる色彩を作り出すことができるのです。陶芸家は、窯の焼成雰囲気を調整することで、これらの酸化数をコントロールし、望みの色を引き出しています。
<参考リンク>
日本セラミックス協会の酸化還元反応と釉薬発色に関する技術資料では、各種金属イオンの酸化数と発色の関係が詳しく解説されています。
高校化学基礎 酸化数の増減と酸化・還元 - Try IT
酸化数(求め方・ルール・例外・例題・一覧・演習問題)- 化学のグルメ
半反応式・イオン反応式のつくり方をわかりやすく解説 - 受験化学コーチわたなべ