酸化還元反応と化学反応式
陶器や食器に美しい色彩をもたらす釉薬の発色は、焼成時に起こる酸化還元反応という化学反応によって決まります。酸化還元反応とは、物質間で電子が移動する反応のことで、電子を失う反応を「酸化」、電子を受け取る反応を「還元」と呼びます。この反応は、陶芸の世界だけでなく、私たちの日常生活のあらゆる場面で見られる重要な化学現象です。
参考)https://pigboat-don-guri131.ssl-lolipop.jp/232%20Oxidizing%20agent%20and%20reducing%20agent.html
化学反応式は、この酸化還元反応を記号と数字で表現したものです。例えば銅と酸素が反応して酸化銅ができる反応は「2Cu + O2 → 2CuO」と表されます。この式では、銅原子(Cu)の酸化数が0から+2に増加しているため「酸化された」といい、酸素原子(O)の酸化数が0から-2に減少しているため「還元された」と表現します。
参考)【高校化学基礎】「酸化数の増減と酸化・還元」
酸化還元反応では、酸化数の増加量の総和と減少量の総和は必ず等しくなるという重要な法則があります。この法則を利用することで、複雑な化学反応式を正確に作成することができます。陶器の焼成においても、この原理が釉薬の色の変化を左右する重要な要因となっています。
参考)http://saitenhyogo.kir.jp/chemgroup/13redox.PDF
酸化還元反応の化学反応式作成方法
酸化還元反応の化学反応式を作成するには、まず「半反応式」を理解する必要があります。半反応式とは、酸化または還元の反応だけを電子(e⁻)を含めて表した式のことです。半反応式の作成は、次の5つのステップで行います。
参考)半反応式・酸化還元反応式(作り方・覚え方・問題演習など)
まず、酸化剤または還元剤が「何から何になるのか」を書きます。例えば過マンガン酸イオンなら「MnO4⁻ → Mn2+」となります。次に、酸素と水素以外の原子の数を合わせ、その後O原子の数をH2Oを使って調整します。さらにH原子の数をH+で合わせ、最後に両辺の電荷を電子(e⁻)を用いて調整します。
参考)化学 16−1 半反応式と酸化還元反応式
このプロセスにより、例えば過マンガン酸カリウムの半反応式は「MnO4⁻ + 8H+ + 5e⁻ → Mn2+ + 4H2O」となります。この半反応式と還元剤の半反応式を組み合わせることで、完全な酸化還元反応式を作成できます。電子の数を揃えて足し合わせ、両辺の電子を消去することがポイントです。
参考)【高校化学基礎】「酸化還元反応式のつくり方」
半反応式を使った化学反応式の作成は、陶芸における釉薬の化学変化を理解する上でも非常に役立ちます。焼成時に窯の中で起こる複雑な化学反応も、この基本原理に基づいて説明することができるのです。
参考)焼き物を科学する③:美しさを追求した釉薬(市川しょうこ/化学…
半反応式の詳しい作成手順と練習問題
酸化還元反応式を確実に作成するための5ステップと具体例が詳しく解説されています。
酸化還元反応における酸化剤と還元剤
酸化還元反応では、酸化剤と還元剤という2種類の物質が重要な役割を果たします。酸化剤とは、相手の物質から電子を奪い取る(相手を酸化する)物質のことで、自身は電子を受け取るため還元されます。一方、還元剤は相手の物質に電子を与える(相手を還元する)物質で、自身は電子を失うため酸化されます。
参考)酸化剤・還元剤(違い・見分け方・例・一覧など)
代表的な酸化剤には、過マンガン酸カリウム(KMnO4)、二クロム酸カリウム(K2Cr2O7)、過酸化水素(H2O2)などがあります。これらは強力な酸化作用を持ち、漂白剤や消毒剤として日常生活でも利用されています。過マンガン酸カリウムは紫色から無色に変化するため、滴定の際に指示薬が不要という特徴があります。
参考)漂白剤で洗濯物が白くなる理由、化学反応式について解説【高校生…
還元剤としては、二酸化硫黄(SO2)、硫化水素(H2S)、シュウ酸(H2C2O4)などが挙げられます。興味深いことに、過酸化水素は通常は酸化剤として働きますが、過マンガン酸カリウムのような強い酸化剤と反応する際には還元剤として機能します。このように物質の性質は反応相手によって変化することがあり、酸化還元反応の奥深さを示しています。
参考)https://niigatasuikou-h.nein.ed.jp/tsushin/16S/16kagaku1.pdf
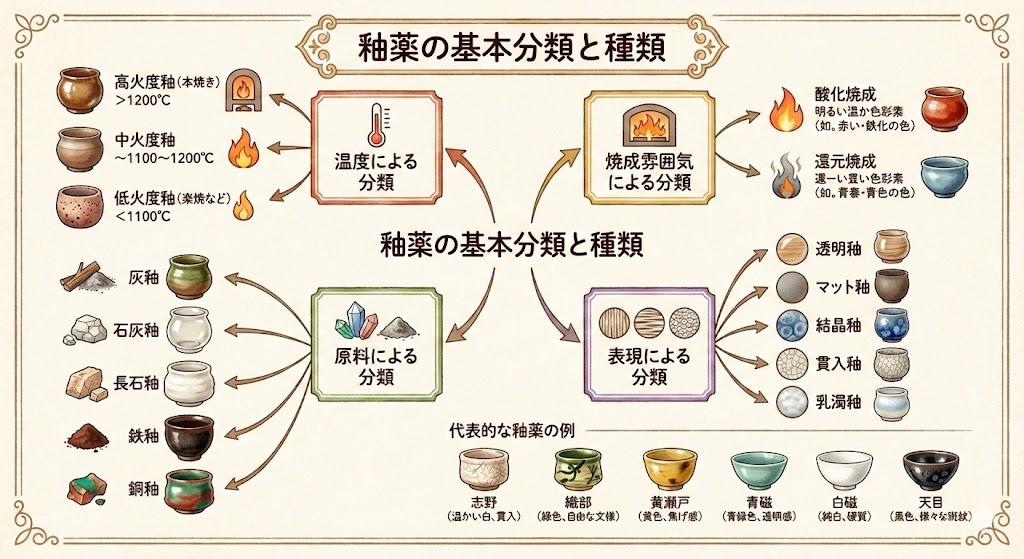
酸化還元反応と陶器釉薬の発色メカニズム
陶器や食器の美しい色合いは、釉薬に含まれる金属成分が焼成時に起こす酸化還元反応によって生み出されます。釉薬とは陶磁器の表面を覆うガラス質の層のことで、基本成分にシリカ(SiO2)、アルミナ(Al2O3)、そして着色酸化物を含んでいます。この着色酸化物として鉄、銅、コバルト、マンガンなどの金属成分が使われ、これらが酸化還元反応を起こすことで多彩な色が生まれます。
参考)釉薬の基本と応用|色の出方と重ね掛けのテクニック|亀井俊哉|…
焼成方法には「酸化焼成」と「還元焼成」の2種類があり、これが釉薬の発色に決定的な影響を与えます。酸化焼成とは、窯の中に十分な酸素を供給して焼く方法で、電気窯で行われるのが一般的です。この条件下では金属イオンが酸素と結びつきやすく、釉薬の色が安定します。一方、還元焼成は酸素が不足した状態で焼く方法で、ガス窯や薪窯で実現されます。
参考)焼いてみないとわからない酸化と還元 - ceramicsst…
還元焼成では不完全燃焼状態となり、燃料と反応する酸素が不足するため、窯内の一酸化炭素が土や釉薬から酸素を奪う化学反応が起こります。この還元反応により、金属成分から酸素が奪われることで、酸化焼成とはまったく異なる色合いが生まれるのです。例えば、同じ釉薬でも焼成方法を変えるだけで緑色から青色へ、あるいは黄色から赤色へと劇的に変化します。
還元と酸化が陶器の色に与える影響の科学的解説
陶磁器における酸化還元反応のメカニズムと釉薬の発色原理について詳しい解説があります。
酸化還元反応による鉄と銅の発色変化
陶器の釉薬に最もよく使われる着色成分は酸化鉄と酸化銅です。これらの金属成分は、酸化還元反応により驚くほど多様な色を生み出します。酸化鉄を含む釉薬では、鉄の酸化状態によって発色が大きく変わります。酸化焼成では酸化第二鉄(Fe2O3)となり、黄色や黄褐色、飴色などの暖色系の色を示します。一方、還元焼成では酸化第一鉄(FeO)に変化し、青磁の美しい青緑色を生み出します。
参考)https://blog.goo.ne.jp/meisogama-ita/e/a8cdccd3e9ced4e3c1d877d0dc1e7696
青磁釉は鉄分を1~2%程度添加した釉薬を還元焼成することで得られ、酸化第一鉄が多量に生成されることで独特の青緑色に発色します。鉄分の含有量によっても色味が変化し、少量であれば淡い青白磁や透明感のある釉になり、2.5%以上になると焦茶色から茶色、灰色、黒色まで多様な色を発色します。さらに12%以上の多量に鉄分が添加されると、冷却中に結晶として析出し、鉄砂釉や鉄赤釉などの美しい結晶釉になります。
参考)青磁の色味の秘密:鉄分と焼成方法が生み出す美しさ|松尾靖隆
銅を含む釉薬も酸化還元反応により劇的な色の変化を見せます。酸化焼成では銅の酸化により緑青のような緑系の色になります。これは銅が酸素と結びついて安定した状態になるためです。しかし還元焼成では、釉薬中の酸化金属から酸素が奪われることで、銅本来の赤銅色が現れます。有名な「織部」の釉薬は、酸化焼成では緑色になりますが、還元焼成では赤色(辰砂)に変化します。このように同じ釉薬でも焼成条件を変えるだけで、まったく異なる表情を見せるのが陶芸の魅力です。
酸化還元反応と窯変による独特の表現
陶芸において「窯変(ようへん)」とは、焼成中に窯の中で起こる予期しない化学変化により、釉薬が意図しない色や模様に変化する現象を指します。この窯変こそが、酸化還元反応の複雑さと奥深さを象徴する現象であり、作家にとっては偶然の美を生み出す貴重な機会となっています。窯内の炎の当たり方、酸化・還元の雰囲気変化、冷却速度などのわずかな違いが、同じ配合の釉薬でも再現不可能な唯一無二の表情を作り出します。
参考)窯変(ようへん):窯の中で起こる変化について
釉薬に微量の鉄分が含まれている場合、酸化焼成では黄色の焼き色となりますが、還元焼成では青~緑色の発色が得られます。この色の変化は窯変の代表例であり、意図的にコントロールすることも、偶然の産物として楽しむこともできます。灰釉(はいゆう)のような天然素材を使った釉薬では、窯変の効果がより顕著に現れます。木灰に含まれる成分が複雑に反応し合い、青磁調の透明感や飴色の素朴な土味など、多彩な表情を見せるのです。
還元焼成の技法では、釉が融け始める900℃~950℃頃からガスの炎を窯に入れて酸素が少ない状態で焼成させます。この不完全燃焼状態で作品中の土や釉から酸素を奪うことで還元反応が引き起こされ、酸化焼成では得られない独特の色合いが生まれます。しかしこの反応は非常に不安定で、釉薬の色が不思議に変化したり、色のムラが生じたりします。このような予測困難な変化が、かえって作品に個性と深みを与え、世界に二つとない一点物の魅力を生み出すのです。
参考)酸化と還元
灰釉の発色メカニズムと還元焼成による表情の変化
木灰を使った天然ガラス釉が酸化還元焼成でどのように変化するか、詳しい解説があります。
酸化還元反応の日常生活への応用
酸化還元反応は陶芸の世界だけでなく、私たちの日常生活のあらゆる場面で重要な役割を果たしています。最も身近な例は鉄製品の錆びです。自転車や鉄製の食器が茶色く変色する錆びは、鉄が空気中の酸素や水と反応する酸化還元反応によって起こります。この反応は「4Fe + 3O2 + 6H2O → 4Fe(OH)3」という化学反応式で表され、鉄が電子を失って酸化され、酸素が電子を受け取って還元される過程を示しています。
参考)酸化還元反応:身の回りの化学現象を理解する|Gelate(ジ…
漂白剤による洗濯も酸化還元反応の応用例です。漂白剤に含まれる酸化剤は、汚れから電子を奪い取ることで色素や有機物の構造を変化させ、汚れを分解します。酸化型漂白剤は酸素と結びつく性質を利用して、食べこぼし、油汚れ、カビ、細菌などの有機物の汚れを効果的に分解するのです。この原理は、食器の頑固な汚れを落とす際にも活用されています。
参考)お掃除の中での酸化と還元
さらに私たちが生きていくために必要な呼吸も、実は酸化還元反応です。体内で食べ物から得たブドウ糖が、吸い込んだ酸素によって「燃やされ」、「C6H12O6 + 6O2 → 6CO2 + 6H2O + エネルギー」という反応でエネルギーが生み出されます。このようにエネルギー生産、金属の精錬、化学工業、生化学反応、環境浄化、食品保存など、酸化還元反応は生活のあらゆる場面で不可欠な化学反応なのです。陶器の美しい釉薬の色も、このような基本的な化学原理の応用から生まれているのです。
参考)日常生活での酸化還元反応観察 ~ 抗酸化物質による健康法(1…

実験くん No.99 酸化銅 炎色反応薬品 鮮やかな緑の炎 STEM教育 化学を遊ぶ。<プレゼントのお知らせ>自由研究に最適!実験くんガイドブック(税込550円)を商品お買上げの皆様にもれなくプレゼントいたします。