硫酸イオンと硫化物イオンの違い
硫酸イオンの化学式と構造
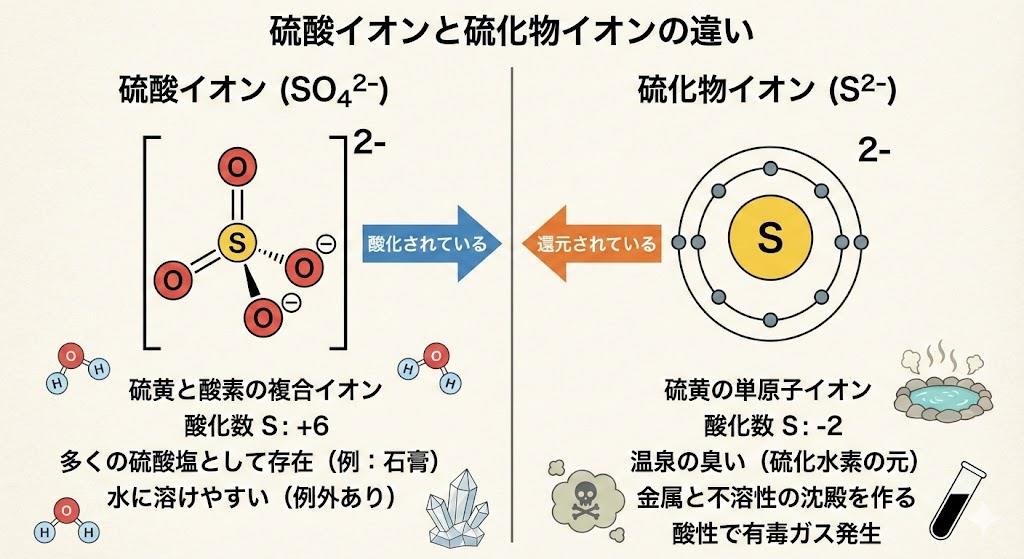
硫酸イオン(SO₄²⁻)は、中心の硫黄原子を正四面体配置で囲む4つの等価な酸素原子から構成される多原子イオンです。硫黄原子の酸化状態は+6価であり、4つの酸素原子はそれぞれ−2の酸化状態にあります。S-O結合長は149ピコメートルで、これはS-O単結合から予測されるよりも短く、硫酸におけるS-OH結合長の157ピコメートルと比べても短い距離です。
参考)硫酸塩 - Wikipedia
この四面体型構造は、硫黄原子と酸素原子間に共有結合に加えてクーロン力(イオン結合的な力)が働いているため実現されています。硫酸イオンは2価の負電荷を有しており、硫酸水素イオン(HSO₄⁻)の共役塩基として存在します。希硫酸中では硫酸イオンは低濃度でしか存在せず、陰イオンの多くは硫酸水素イオンとして存在し、硫酸濃度を10⁻² mol/dm³程度以下に希釈して初めて硫酸イオンが主な化学種となります。
参考)硫酸 - Wikipedia
硫化物イオンの化学式と性質
硫化物イオン(S²⁻)は、硫黄原子が電子2つを受け取って生成される単原子の2価陰イオンです。硫黄のイオンであり、酸化状態は−2価という還元状態にあります。硫化物イオンは硫化水素(H₂S)や硫化ナトリウムなどから生成され、水溶液中では硫化水素イオン(HS⁻)や硫化水素と平衡状態にあります。
参考)硫化物イオンと硫酸イオンの違いが知りたいです松 - Cl…
硫化水素と硫化物イオンの酸塩基平衡はpKa=7.04なので、中性から少しpHが低下するだけでH₂Sが支配的になりガス化しやすくなります。硫化物イオンは金属イオンと反応して難溶性の硫化物沈殿を形成しやすい性質があり、特にCd²⁺、Sn²⁺、Pb²⁺、Cu²⁺、Hg²⁺、Ag⁺などのイオンとは液性に関わらず沈殿を生成します。硫化物の多くは黒色を呈しますが、硫化亜鉛(ZnS)は白色、硫化カドミウム(CdS)は黄色、硫化マンガン(MnS)は桃色など、金属イオンによって沈殿の色は異なります。
参考)水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸・クロム…
硫酸イオンと硫化物イオンの検出方法
硫酸イオンの検出には、Ba²⁺、Sr²⁺、Ca²⁺、Pb²⁺などの金属イオンを用いた沈殿生成反応が利用されます。特に硫酸バリウム(BaSO₄)は水に極めて難溶性であるため、硫酸イオンの検出や除去に広く用いられています。イオンクロマトグラフィーでは、炭酸ナトリウム溶液を用いた振とう抽出法により硫酸イオンを抽出し、電気伝導度検出法やUV吸光度測定法で定量することができます。
参考)イオン分析を行う上で必要な知識まとめ
硫化物イオンの検出では、金属イオンとの錯体形成反応を利用する方法が開発されており、硫化物イオンが金属イオンと金属指示薬の発色反応を阻害もしくは促進する性質を活用します。メチレンブルー法などの発色法も広く用いられており、硫化物イオンが特定の試薬と反応して呈色する性質を利用して定量分析が行われます。硫化水素の揮散-捕集(トラップ)法では、酸性の分解溶液中でS²⁻がH₂Sとして揮散することを活用した分析が可能です。
参考)https://packtest.jp/pdf-mtsp/mtsp-s.pdf
硫酸イオンと硫化物イオンの水溶液中での挙動
硫酸イオンは水溶液中で非常に安定な化学種であり、自然水中では地質に起因して平均20mg/L程度含まれています。海水には2700mg/Lと高濃度で含まれるため、河口域取水の場合は高めの値となります。硫酸イオンは強酸の硫酸の共役塩基であるため、水溶液中でほとんど加水分解を起こさず、安定した四面体構造を保ちます。
参考)https://www.waterpartners.jp/1_engineer/10_quality/raccoon_quality_sulfide.htm
一方、硫化物イオンは水溶液中で不安定であり、pHによって存在形態が大きく変化します。pHが2〜9の範囲では硫化水素(H₂S)、硫化水素イオン(HS⁻)、硫化物イオン(S²⁻)が平衡状態で共存しますが、pHが低いほど硫化水素として存在する割合が高くなります。硫化物イオンは還元性が強く、空気に触れると徐々に酸化されてS(4+)やS(6+)の状態に変化し、最終的には硫酸イオンにまで酸化されることがあります。
参考)https://www2.tagen.tohoku.ac.jp/lab/muramatsu/html/MURA/kogi/kaimen/kaimen2002/2002-5-2.pdf
硫酸イオンの陶器・ガラスとの関係
硫酸イオンは陶器やガラスの製造過程において重要な役割を果たしています。ガラス材料では硫酸ナトリウム(Na₂SO₄)の形で添加され、清澄剤およびアンバー発色剤として機能します。清澄とはガラスの脱泡のことであり、Na₂SO₄の分解によるSO₂ガスの発生により泡のサイズを増大させ、浮上脱泡させる仕組みです。また、硫酸ナトリウムは酸化鉄や還元剤とともに添加されることで、Fe³⁺-S²⁻-アルカリ金属イオンによる発色団が形成され、ガラスに琥珀色を与えます。
参考)ガラス中の多価元素の価数別化学分析方法の開発(1)硫化物硫黄…
陶器の場合、硫酸イオンは海成層由来の粘土に含まれることがあり、還元状態での焼成時に問題を引き起こすことがあります。硫酸バリウムを添加して硫酸根を不溶性の形で除去する処理が行われることもあります。硫酸は陶器やガラスとは反応しないため、陶磁器表面の釉薬(ガラス質)は硫酸に対して化学的に安定です。ガラス中では硫黄がS²⁻およびS⁶⁺の形で残存し、これらの硫黄の価数別の濃度がガラス特性に影響を与えるため、定量方法が重要となります。
参考)https://www.pref.mie.lg.jp/common/content/001184237.pdf
硫化物イオンの釉薬における発色と反応
硫化物イオンは陶器の釉薬において、金属イオンと結合して特徴的な発色を生み出す重要な要素です。釉薬の発色に関係する非金属元素のイオンとして、硫黄や硫化カドミウム、セレンなどがあり、これらは金属イオンと複合的に作用して色彩を生成します。硫化物イオン(S²⁻)は金属イオンと結合し、水に溶けにくい沈殿を生成する性質があり、硫化銅(CuS)や硫化亜鉛(ZnS)などの難溶性塩は釉薬中で安定な発色団を形成します。
参考)陶芸の釉薬について、詳しい方お願いします。鉄の融点は1500…
ガラス製造においては、不純物としての硫黄がガラス中の陽イオンと有色硫化物を作ることが多いため、光学ガラス原料中に微量でも含むことは避けなければなりません。鉄釉陶器では、酸化鉄が還元雰囲気下で焼成されると鉄イオンの酸化状態が変化し、硫化物との相互作用により褐色から黒色まで様々な色合いを示します。釉薬中の金属酸化物は高温で焼成する際に化学反応を起こし、窯内の酸素濃度(酸化雰囲気か還元雰囲気か)によって金属イオンの価数が変化し、硫化物イオンとの結合状態も変わるため、同じ組成でも全く異なる発色を引き出すことができます。
硫酸イオンと硫化物イオンの相互変換
硫酸イオンと硫化物イオンは、環境条件によって相互に変換される可能性があります。硫黄は硫化水素(S²⁻の酸化状態)から硫酸イオン(S⁶⁺の酸化状態)まで、様々な酸化状態をとることができ、「硫黄七変化」とも呼ばれています。鉱物中では通常、硫黄はS(0)やS(2-)の状態にありますが、空気に触れるとか高温下で水に接触すると、硫黄は徐々に酸化されてS(4+)、S(6+)になります。
硫化物鉱物が固体状態でアルカリ水溶液にふれると、徐々に鉱物中の硫黄が酸化されることも知られています。地下でアルカリ性の高温水が硫化銅(CuS)などの鉱物に作用すると、Sが酸化されて溶けだしてきます。下水管内では、硫化水素が酸素と反応して硫酸を生成し、これがコンクリや鉄を腐食する現象が起こります。硫化水素と酸素との反応には、硫黄酸化細菌と呼ばれる微生物の働きが関わっており、生物学的な酸化プロセスによって硫化物イオンから硫酸イオンへの変換が促進されます。
参考)https://www.wwmlab.info/post/%E4%B8%8B%E6%B0%B4%E9%81%93%E3%81%AE%E9%99%A5%E6%B2%A1%E4%BA%8B%E6%95%85
硫酸イオンと硫化物イオンの環境・生物学的意義
硫酸イオンは生理学的に重要な役割を果たしており、システインやメチオニンの最終代謝産物として知られています。適切な硫酸イオン濃度は生理システムにおける重要な機能の発現に関連しており、その濃度を正確なレベルに維持することは生物学、環境、産業生産にとって非常に重要です。硫酸イオンの認識と分離に関する研究では、結晶化や液-液抽出を用いた手法が開発されており、硫酸関連の生理学的プロセスや浄化への応用が期待されています。
参考)https://pmc.ncbi.nlm.nih.gov/articles/PMC9099046/
硫化物イオンは環境中で様々な形態で存在し、環境状態の重要な指標となります。土壌や底泥中のイオウの形態分析では、酸揮発性イオウとしてモノ硫化物や亜硫酸イオンとともに測定されます。温泉水中では硫化水素として存在し、独特の臭いと還元性を示します。硫化水素や硫化物イオンの測定は、環境モニタリングや水質管理において重要であり、簡便で高感度な定量法の開発が求められています。バクテリアによる元素状硫黄の酸化においても、硫化物イオンや硫酸イオンの濃度が微生物の活性に影響を与えることが知られています。
参考)https://www.oceanochemistry.org/publications/TRIOC/PDF/trioc_1999_12_26.pdf
硫化物イオンと硫酸イオンの基本的な違いについて、化学式とイオンの由来を簡潔に解説した学習サイト
硫酸イオンの正四面体構造とS-O結合の詳細、VSEPR理論による構造予測について解説したWikipedia記事
ガラス中の硫酸塩硫黄と硫化物硫黄の定量方法、清澄剤とアンバー発色の仕組みを詳述した研究論文
温泉化学における硫黄の酸化状態変化、硫化水素から硫酸イオンまでの「硫黄七変化」を解説した資料