完全燃焼の化学反応式
完全燃焼とは何か
完全燃焼とは、炭素や水素を含む物質が十分な酸素の存在下で反応し、二酸化炭素CO₂と水H₂Oを生成する化学変化です。この反応では光や熱を激しく放出するため、燃焼と呼ばれます。有機物には必ず炭素原子と水素原子が含まれているため、完全燃焼させると必ずこれらの生成物ができます。
例えば炭素Cが酸素O₂と反応する場合、化学反応式はC + O₂ → CO₂となります。同様に水素H₂が酸素と反応すると2H₂ + O₂ → 2H₂Oという式で表されます。これらは物質が酸素と結びつく酸化反応の一種であり、特に激しく進行するものを燃焼と定義しています。
燃焼には完全燃焼と不完全燃焼の2種類があります。酸素が不足すると一酸化炭素COや炭素Cが生成される不完全燃焼が起こりますが、十分な酸素があれば完全燃焼が進行します。
完全燃焼のメタンとプロパンの化学反応式
代表的な炭化水素であるメタンCH₄の完全燃焼は、CH₄ + 2O₂ → CO₂ + 2H₂Oという化学反応式で表されます。メタン1分子に対して酸素2分子が必要で、二酸化炭素1分子と水2分子が生成されます。係数は反応の前後で原子の数が等しくなるように調整されており、左辺の炭素原子1個、水素原子4個、酸素原子4個が右辺でも同じ数だけ存在します。
プロパンC₃H₈の完全燃焼の場合、より多くの酸素が必要になります。化学反応式はC₃H₈ + 5O₂ → 3CO₂ + 4H₂Oとなり、プロパン1分子に対して酸素5分子が反応して二酸化炭素3分子と水4分子を生成します。炭素原子が3個、水素原子が8個含まれているため、それぞれに対応する生成物の係数が決まります。
これらの化学反応式を作成する際の基本手順は、まず炭素の数からCO₂の係数を決め、次に水素の数からH₂Oの係数を求め、最後に酸素原子の総数からO₂の係数を調整します。この方法は炭化水素だけでなくエタノールなどの含酸素化合物にも応用できます。
化学基礎 定期テスト対策完全燃焼を表す反応式の書き方
メタンやプロパンなど様々な炭化水素の完全燃焼の化学反応式の作り方が詳しく解説されています。
完全燃焼のエタノールと有機物の化学反応式
エタノールC₂H₅OHの完全燃焼は、C₂H₅OH + 3O₂ → 2CO₂ + 3H₂Oという化学反応式で表現されます。エタノールは炭素、水素、酸素を含む化合物ですが、完全燃焼の生成物は炭化水素と同じく二酸化炭素と水です。エタノール1分子に対して酸素3分子が必要で、二酸化炭素2分子と水3分子が生成されます。
有機物全般の完全燃焼は、有機物 + 酸素 → 二酸化炭素 + 水という一般式で表すことができます。砂糖、紙、木材など様々な有機物を燃やすと必ず二酸化炭素と水が発生するのは、これらすべてに炭素と水素が含まれているためです。この性質を利用して、ある物質が有機物かどうかを判定することもできます。
エタノールの燃焼は発熱反応であり、熱エネルギーと光エネルギーを放出します。この特性からエタノールは燃料として利用されており、バイオ燃料としても注目されています。化学反応式から、エタノール46gを完全燃焼させるには酸素96gが必要で、二酸化炭素88gと水54gが生成されることが計算できます。
エタノールの燃焼反応と酸化反応の違いとは?分かりやすく解説!
エタノールの完全燃焼と不完全燃焼の違い、酸化反応との関係について化学的に詳しく説明されています。
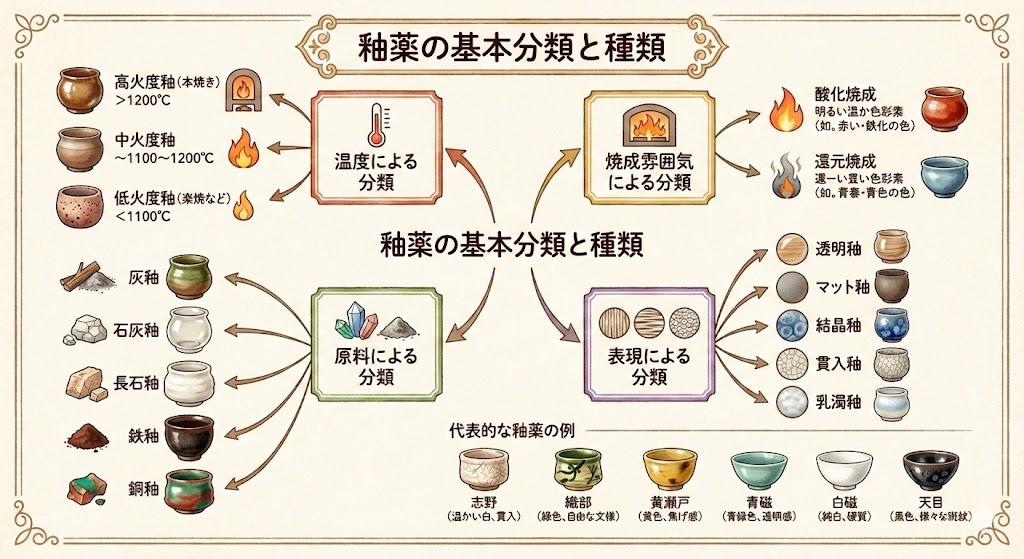
完全燃焼と陶器焼成の酸化反応
陶器の焼成における酸化焼成は、完全燃焼の原理を応用した技法です。窯の中に十分な酸素を供給しながら焼成すると、素地や釉薬に含まれる金属分が酸素と結合して酸化物を形成します。この状態を酸化焼成または完全燃焼状態と呼び、素地に含まれる鉄分が酸化鉄に変化して赤茶色や黄色の発色が現れます。
化学反応式で表すと、燃料の炭素が完全燃焼する反応はC + O₂ → CO₂となります。窯内に酸素が過剰に存在する場合、燃焼反応で消費されなかった酸素が釉薬や素地の成分と反応します。例えば銅を含む釉薬は酸化焼成すると緑色に発色し、鉄分を含む釉薬は黄色や赤褐色になります。
一方、酸素を制限した不完全燃焼状態での焼成を還元焼成と呼びます。この場合、窯内で一酸化炭素が発生し、素地や釉薬から酸素を奪う還元反応が起こります。同じ釉薬でも酸化焼成と還元焼成では全く異なる色合いになり、陶芸家は意図する表現に応じて焼成方法を使い分けています。
酸化焼成と還元焼成の違い|土岐市公式ウェブサイト
陶器の焼成における酸化焼成と還元焼成の違いが、完全燃焼と不完全燃焼の観点から解説されています。
完全燃焼の係数決定と物質量計算
化学反応式の係数を正確に決定することは、完全燃焼の理解において重要です。係数決定法では、まず反応物と生成物を化学式で書き、次に各元素の原子数が反応の前後で等しくなるように係数を調整します。炭化水素CₘHₙの一般的な完全燃焼式は、CₘHₙ + (m + n/4)O₂ → mCO₂ + (n/2)H₂Oとなります。
物質量を使った計算では、化学反応式の係数が物質量の比を表すことを利用します。例えばメタンCH₄が1mol完全燃焼すると、酸素2molが必要で二酸化炭素1molと水2molが生成されます。標準状態でメタン22.4Lを完全燃焼させるには酸素44.8Lが必要という計算ができます。
混合気体の燃焼問題では、メタンとプロパンのような複数の炭化水素が混在する場合があります。この場合、各成分について別々に化学反応式を立て、生成する二酸化炭素や消費する酸素の合計を求めます。連立方程式を利用することで、混合比率や各成分の物質量を計算することができます。
混合気体の燃焼と体積に関する問題の解き方
メタンとプロパンの混合気体の完全燃焼における化学反応式と計算方法が詳しく解説されています。
完全燃焼と陶器の色彩変化のメカニズム
陶器の焼成温度と雰囲気は、完全燃焼の制御によって調整されます。酸化焼成では燃料が完全燃焼するため、窯内温度を効率的に上昇させることができ、1200℃から1300℃という高温が達成されます。この高温状態で粘土中のカオリナイトが化学変化を起こし、ムライトやクリストバライトなどの結晶が形成されて素地が焼き締まります。
釉薬の発色メカニズムは酸化還元反応と密接に関係しています。酸化鉄を約2%含む釉薬を酸化焼成すると、鉄イオンが二価Fe²⁺の状態となり黄色い色合いを示します。一方、酸化鉄を約8%含む釉薬を高温還元焼成すると、金属鉄が生成されて冷却過程で酸化されることで赤色に発色します。この現象は完全燃焼と不完全燃焼の切り替えによる化学状態の変化によるものです。
電気窯での焼成は炎を使わないため常に酸化焼成となりますが、ガス窯や薪窯では空気の供給量を調整することで酸化と還元を制御できます。陶芸家はこの化学的な知識を経験と組み合わせて、意図した色や質感を持つ作品を生み出しています。焼成は単なる加熱ではなく、複雑な化学反応を制御する科学的なプロセスなのです。
焼き物を科学する③:美しさを追求した釉薬
酸化鉄の化学状態の変化と陶器の発色の関係について、焼成雰囲気との関連で詳しく解説されています。
完全燃焼の応用例と燃焼エネルギー
完全燃焼の原理は様々な場面で応用されています。家庭用ガスコンロではメタンやプロパンを完全燃焼させることで効率的に熱エネルギーを得ており、青い炎は完全燃焼の証です。不完全燃焼で赤い炎になると一酸化炭素が発生して危険なため、常に十分な換気が必要とされます。
燃焼熱または燃焼エンタルピーは、物質1molが完全燃焼するときに発生する熱量です。メタンCH₄の燃焼エンタルピーは-890 kJ/molであり、これは1molのメタンが完全燃焼すると890 kJの熱エネルギーが放出されることを意味します。この数値は化学反応式から理論的に計算でき、燃料の効率を評価する指標となります。
陶芸窯の設計においても燃焼効率の計算は重要です。メタンを燃料とする窯で1000℃に到達するには、化学量論比に基づいた適切な空気とメタンの混合比が必要です。燃焼効率を最大化するには、過剰な酸素も不足も避け、理論空燃比に近い条件で運転することが求められます。完全燃焼の化学反応式を理解することで、エネルギー効率の良い燃焼制御が可能になります。
Evaluating the combustion process of methane fired cross draft ceramic kiln for efficiency and sustainability
メタンを燃料とする陶芸窯における燃焼プロセスの効率評価と化学量論計算について詳細に記載されています。