塩基性酸化物 金属 なぜ
塩基性酸化物と金属の電気陰性度の関係
金属元素が塩基性酸化物を形成しやすいのは、金属の電気陰性度が非金属元素と比べて低いことが根本的な理由です。電気陰性度とは、原子が電子を引き付ける力の強さを示す指標であり、金属元素は電子を放出しやすい性質を持っています。
参考)どうして金属元素は塩基性酸化物が多いのですか? - Yaho…
酸素は電気陰性度が非常に高い元素であるため、金属と酸素が結合すると、電子は酸素側に大きく偏ります。この電気陰性度の差が大きいほど、結合はイオン結合性を帯びることになります。その結果、金属元素の酸化物は金属イオン(陽イオン)と酸化物イオンO2-から構成されるイオン性化合物となり、塩基性の性質を示すのです。
参考)酸性の酸化物と塩基性の酸化物の違いとは?分かりやすく解説! …
電気陰性度の小さい金属ほど、電子を手放しやすく陽イオンを形成しやすいため、より強い塩基性酸化物を作ります。例えば、アルカリ金属やアルカリ土類金属の酸化物は特に塩基性が強く、水と激しく反応して水酸化物を生成します。
参考)電気陰性度 - okke
塩基性酸化物のイオン結合構造
金属元素の酸化物が塩基性を示す理由は、その結合がイオン結合であることに深く関わっています。金属原子と酸素原子が結合する際、金属は電子を失って陽イオンになり、酸素は電子を受け取って酸化物イオンO2-になります。
参考)酸性酸化物・塩基性酸化物・両性酸化物(違い・見分け方・一覧・…
この酸化物イオンO2-こそが塩基性の本質です。酸化マグネシウムMgOを例にとると、Mg2+とO2-が規則正しく配列してイオン結晶を構成しています。この構造により、金属元素の酸化物には必ず酸化物イオンO2-が含まれており、これが塩基性酸化物としての共通の反応性を示す理由となっています。
参考)酸化物の反応(金属元素・非金属元素)
イオン結合性の強い酸化物ほど、水に溶けた際にO2-イオンが放出されやすく、強い塩基性を示します。一方、金属と非金属の境界領域にある元素(アルミニウム、亜鉛など)の酸化物は、イオン結合性と共有結合性の両方を持つため、両性酸化物となります。
参考)http://www.cstf.kyushu-u.ac.jp/~ishihara-lab/lecture/lecture_12.pdf
塩基性酸化物における酸化物イオンの反応性
塩基性酸化物の化学的性質を理解する上で、酸化物イオンO2-の反応性は極めて重要です。O2-は水分子H2Oと比べてH+が2個少ない状態にあるため、H+を強く引き付ける性質を持っています。
水との反応では、O2-がH2OからH+を奪い取り、次のような変化が起こります:O2- + H2O → 2OH-。この反応により水酸化物が生成され、溶液は塩基性を示すようになります。例えば、酸化カルシウムCaOを水に加えると、水酸化カルシウムCa(OH)2が生成されます。
参考)【高校無機化学】酸化物の分類、酸化物と水の反応
酸との反応では、O2-がH+を受け取りやすい性質がより顕著に現れます。酸はH+を放出しやすいため、O2-と反応すると:O2- + 2H+ → H2Oという反応が起こり、水が生成されます。この反応は中和反応の一種であり、塩と水が生成物となります。
参考)何故金属の酸化物は塩基性酸化物になるのですか?金属の性質によ…
意外なことに、酸化物イオンO2-の反応性は、溶液中だけでなく固体状態でも発揮されます。高温状態では、固体の塩基性酸化物が酸性酸化物と直接反応して塩を形成することがあり、これはセラミックスや鉱物の生成過程で重要な役割を果たしています。
参考)https://www.jstage.jst.go.jp/article/sfj1970/24/5/24_5_256/_pdf
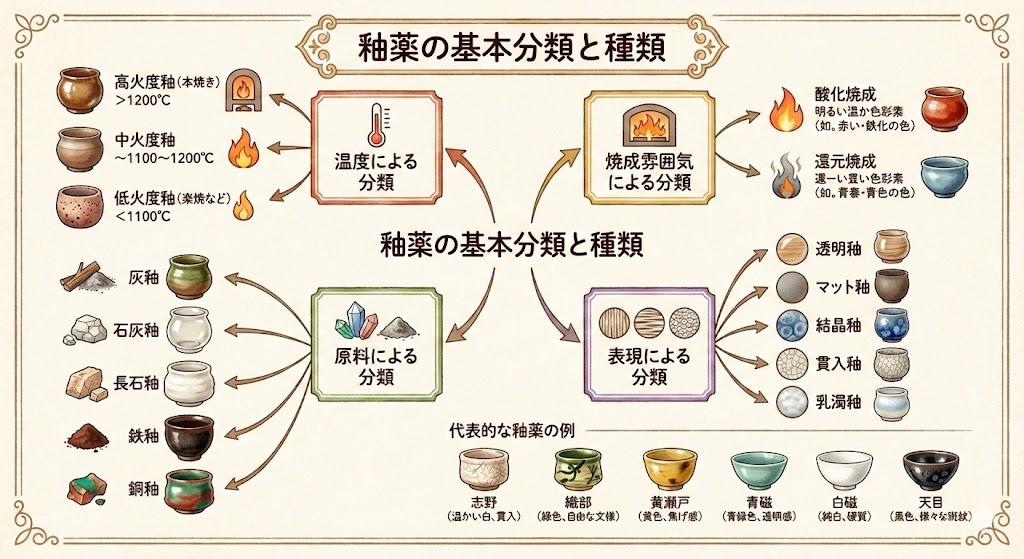
金属酸化物と陶器釉薬の発色メカニズム
塩基性酸化物である金属酸化物は、陶磁器の釉薬において美しい発色を生み出す重要な役割を担っています。釉薬の主な成分は珪酸(シリカ)、長石、灰ですが、そこに酸化鉄や酸化銅などの金属酸化物を加えることで、さまざまな色の焼き上がりになります。
金属成分の種類や量によって発色が変わる仕組みは、金属イオンの電子構造と酸化状態に関係しています。特に重要な発色元素は鉄と銅で、酸化鉄は黄色から褐色、酸化銅は緑や青の発色をもたらします。鉄イオンの場合、Fe2+(第一鉄イオン)とFe3+(第二鉄イオン)では異なる色を示し、これが釉薬の多様な色彩表現を可能にしています。
参考)釉薬の発色に及ぼす融剤および遷移金属の効果
焼成時の酸素量によって発色が大きく変わるのも、金属酸化物の特徴です。酸化焼成では酸素が豊富にあるため、金属が酸素と結合して酸化状態となり、銅は緑系、鉄は赤や茶色になります。一方、還元焼成では窯内の酸素が不足し、釉薬中の金属酸化物から酸素が奪われるため、銅は赤銅色、鉄は青磁のような色になります。
参考)https://bitouen.jp/blog_k1606196331.html
陶器職人は、この化学反応を巧みに利用して、同じ金属酸化物から全く異なる色を引き出しています。窯の温度、昇温速度、冷却速度、燃料の種類など、細かな条件を調整することで、一つひとつ異なる表情の作品が生み出されるのです。
参考)色とりどりの焼き物に込められた「釉薬」の不思議|全国大陶器市
塩基性酸化物の分類と見分け方
酸化物を塩基性酸化物、酸性酸化物、両性酸化物に分類する際には、元素の位置と性質を理解することが重要です。一般的に、金属元素の酸化物は塩基性酸化物であり、非金属元素の酸化物は酸性酸化物となります。
参考)【高校無機化学】酸化物の分類、酸化物の中和反応
周期表上で金属元素と非金属元素の境界付近に位置する元素(アルミニウムAl、亜鉛Zn、スズSn、鉛Pb)は両性金属と呼ばれ、その酸化物は両性酸化物に分類されます。これらの酸化物は、酸とも塩基とも反応できる特殊な性質を持っています。
参考)両性元素とは(覚え方)
塩基性酸化物の見分け方として、次の特徴があります。
- 金属元素を含む酸化物である
- 水と反応して水酸化物(塩基)を生成する
参考)【高校化学】「酸化物の分類」
- 酸と反応して塩と水を生成する
- 必ず酸化物イオンO2-を含んでいる
酸化物の塩基性の強さは、中心金属の電気陰性度によって決まります。電気陰性度が小さい金属ほど、強い塩基性酸化物を形成します。例えば、アルカリ金属(リチウム、ナトリウム、カリウムなど)の酸化物は非常に強い塩基性を示し、水と激しく反応します。
参考)https://www.jstage.jst.go.jp/article/jssep/33/0/33_291/_pdf/-char/ja
塩基性酸化物と陶器食器の化学的安全性
陶磁器の釉薬に使用される金属酸化物の安全性は、食器として使用する上で重要な考慮事項です。釉薬は鉱物と酸化物から作られており、正しく焼成されなかったり配合が不安定だったりすると、酸性食品と反応して金属イオンが溶出する可能性があります。
特に注意が必要な金属酸化物として、鉛、カドミウム、コバルト、ニッケルなどがあります。これらの金属は発色に優れた効果を持つ一方で、酸性の食品(コーヒー、オレンジジュース、トマトソースなど)に長時間接触すると溶出するリスクがあります。研究によれば、温度が高いほど、またpH値が低い(酸性が強い)ほど、金属の抽出量が増加することが確認されています。
参考)陶磁器の釉薬は食品に安全か?輝きの裏側にある真実
この問題に対処するため、現代の陶磁器製造では環境と人体に優しい代替材料の開発が進められています。例えば、赤やオレンジの発色に使われてきたセレンやカドミウムを含む絵具の代わりに、より安全な金属酸化物を用いる技術が開発されています。また、釉薬の焼成温度や組成を最適化することで、金属酸化物をガラス質の構造にしっかりと閉じ込め、溶出を防ぐ工夫もなされています。
参考)美しい発色を実現する安全な絵具
興味深いことに、釉薬中の金属酸化物はルイス酸として機能し、食品成分と化学反応を起こすこともあります。緑茶のカテキンが陶磁器の表面で構造変化を起こす現象が報告されており、これは釉薬の触媒作用によるものです。このような反応は、食器と食品の相互作用という新しい研究分野を開拓しています。
参考)陶磁器釉薬表面の触媒作用による緑茶カテキンの構造変化を世界で…
酸性酸化物・塩基性酸化物・両性酸化物の違いと反応について詳しく解説されています
金属元素と非金属元素の酸化物の反応メカニズムを図解で理解できます
陶器の釉薬における金属酸化物の発色メカニズムが科学的に説明されています