イオン化傾向 一覧と金属の性質
イオン化傾向の基本と一覧表
イオン化傾向とは、金属元素が水溶液中で電子を放出して陽イオンになろうとする性質の強さを示すものです。金属原子は電子を失うことで陽イオンに変化しますが、この反応の起こりやすさは金属の種類によって大きく異なります。イオン化傾向が大きい金属ほど電子を放出しやすく、陽イオンになりやすい性質を持っています。
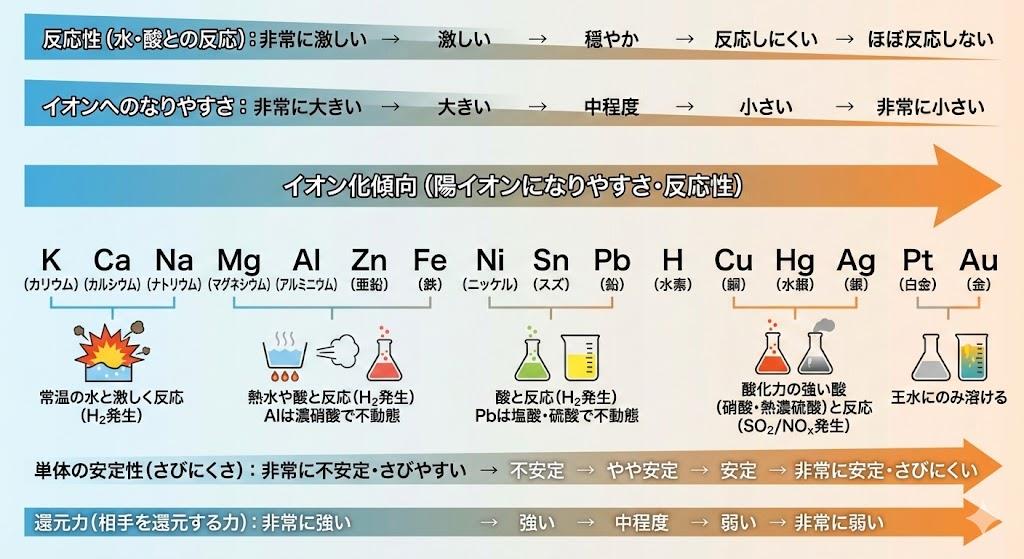
金属元素をイオン化傾向の大きい順に並べたものをイオン化列といいます。代表的なイオン化列は以下の通りです。
Li > K > Ca > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > (H₂) > Cu > Hg > Ag > Pt > Au
この一覧で左側に位置する金属ほどイオン化傾向が大きく、右側に位置する金属ほどイオン化傾向が小さくなります。リチウム(Li)が最もイオン化傾向が大きく、金(Au)が最も小さい金属です。なお、水素(H₂)は金属ではありませんが、比較のため陽イオンになる性質をもつ元素としてイオン化列に含まれています。
イオン化傾向の覚え方と語呂合わせ
イオン化列を正確に記憶することは、化学反応の予測や金属の性質理解に不可欠です。そのため、古くから親しまれている語呂合わせがあります。最も有名なのは「リッチに貸そうかな、まああてにすんな、ひどすぎる借金」という覚え方です。
この語呂合わせは次のように対応しています。
- リッチに(Li):リチウム
- 貸そう(K):カリウム
- か(Ca):カルシウム
- な(Na):ナトリウム
- まあ(Mg、Al):マグネシウム、アルミニウム
- あ(Zn):亜鉛
- て(Fe):鉄
- に(Ni):ニッケル
- すん(Sn):すず
- な(Pb):鉛
- ひ(H₂):水素
- ど(Cu):銅
- す(Hg):水銀
- ぎる(Ag):銀
- 借(Pt):白金
- 金(Au):金
別の覚え方として「貸そうかな、まああてにすんな、ひどすぎる借金」というバージョンもあり、こちらは「リッチに」を省略したものです。語呂の後半につれて金属のイオン化傾向が小さくなる(陽イオンになりにくくなる)というイメージを持つと、問題を解く際に役立ちます。
イオン化傾向と金属の反応性の関係
イオン化傾向は金属の還元力の強さを表しており、酸化還元反応の起こりやすさと密接に関連しています。イオン化傾向の大きい金属ほど還元剤としての力が強く、酸化されやすい性質を持つため、様々な物質と反応しやすくなります。
金属と水の反応を見ると、ナトリウム(Na)よりイオン化傾向が大きい金属は常温の水と激しく反応して水酸化物と水素を生成します。マグネシウム(Mg)は熱水と反応し、鉄(Fe)は水蒸気と反応します。また、鉛(Pb)より水素(H₂)側の金属は希酸(薄い酸)と反応して水素を発生させます。
イオン化傾向が大きい金属ほど電子を失いやすく、空気中の酸素と結びついて酸化されやすいため、錆びやすい性質があります。例えば亜鉛(Zn)は鉄(Fe)よりイオン化傾向が大きいため、鉄より錆びやすい金属です。逆に金(Au)や白金(Pt)のようにイオン化傾向が小さい金属は錆びにくく、長期間美しい光沢を保ちます。
イオン化傾向と標準電極電位の関係
イオン化傾向は標準電極電位という数値で定量的に表すことができます。標準電極電位とは、金属単体とそのイオンが1mol/L存在する溶液の間に生じる起電力(電位差)のことで、水素を基準(0V)として測定されます。
標準電極電位が負の値を示す金属は、単体よりもイオンの方がエネルギーが低く、電子を放出しやすい(陽イオンになりやすい)ことを意味します。逆に標準電極電位が正の値を示す金属は、電子を放出しにくく陽イオンになりにくい性質があります。
主な金属の標準電極電位は以下の通りです。
| 金属元素 | 標準電極電位 |
|---|---|
| リチウム(Li) | -3.045V |
| カリウム(K) | -2.93V |
| カルシウム(Ca) | -2.76V |
| ナトリウム(Na) | -2.71V |
| マグネシウム(Mg) | -2.37V |
| アルミニウム(Al) | -1.66V |
| 亜鉛(Zn) | -0.76V |
| 鉄(Fe) | -0.44V |
| ニッケル(Ni) | -0.26V |
| すず(Sn) | -0.14V |
| 鉛(Pb) | -0.13V |
| 水素(H) | 0.00V |
| 銅(Cu) | +0.34V |
| 銀(Ag) | +0.80V |
| 白金(Pt) | +1.12V |
| 金(Au) | +1.50V |
この数値の順番はイオン化傾向の順番と一致しており、標準電極電位が小さい(より負の値が大きい)金属ほどイオン化傾向が大きいことを示しています。標準電極電位の差が大きい金属を組み合わせると、電池として高い出力電圧を得ることができます。
イオン化傾向の実生活での応用
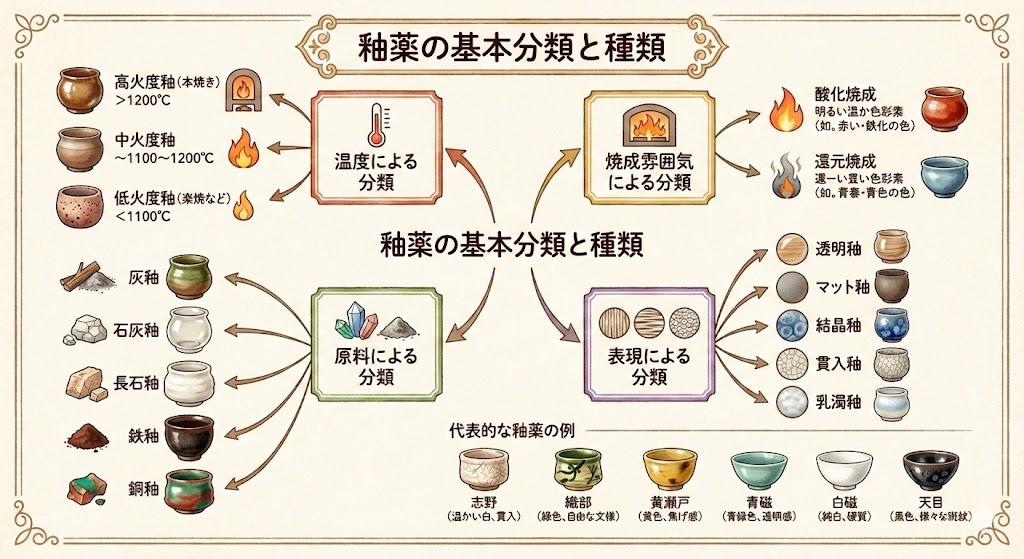
イオン化傾向の知識は、陶器や食器製作を含む様々な実生活の場面で応用されています。特に金属アレルギーの原因理解や、釉薬の発色メカニズムを知る上で重要です。
金属アレルギーになりやすい金属は、イオン化して溶け出しやすい金属、つまりイオン化傾向の高い金属です。ニッケル、コバルト、クロムなどは比較的イオン化傾向が大きいため、皮膚から体内に侵入しやすくアレルギーを引き起こしやすい傾向があります。一方、金や白金、チタンなどはイオン化傾向が小さく、金属アレルギーを起こしにくい安全な素材とされています。陶器や樹脂類(プラスチック類)は金属イオンを放出しないため、金属アレルギーの方でも安心して使用できる食器素材です。
陶磁器の釉薬においても、金属元素のイオン化傾向は重要な意味を持ちます。釉薬に含まれる鉄(Fe)、銅(Cu)、マンガン(Mn)、コバルト(Co)などの金属イオンは、焼成時に酸化還元反応を起こしながら釉層中を拡散し、独特の色彩を生み出します。これらの金属元素の反応性やイオン状態の変化が、焼き物の微妙な色調や質感を決定する要因となっているのです。
食器に使用される陶磁器からの重金属溶出も、イオン化傾向と関連があります。釉薬に含まれる亜鉛やバリウムは、イオン化傾向が比較的大きいため酸性の食品に接触すると一部が溶出する可能性があります。そのため、現代の陶磁器製作では耐酸性を向上させた釉薬の開発や、重金属類を必要最小限に抑える技術研究が進められており、食の安全・安心を求める消費者ニーズに応える努力が続けられています。
また、電池や防錆技術においても、イオン化傾向の原理が広く活用されています。スマートフォンやパソコンに使われるリチウムイオン電池は、イオン化傾向の大きいリチウムの性質を利用した技術です。異なるイオン化傾向を持つ2種類の金属を組み合わせることで、イオン化傾向が大きい金属から電子が放出され、電気エネルギーとして取り出すことができます。
めっき技術では、イオン化傾向の大きい金属で表面を覆うことで母材の腐食を防ぐ「犠牲防食」という方法が用いられます。例えば鉄製品に亜鉛めっきを施すと、亜鉛の方が鉄よりイオン化傾向が大きいため、先に亜鉛が酸化されて鉄本体を保護します。このように、イオン化傾向の理解は金属製品の長寿命化にも貢献しています。
三和メッキ工業株式会社:イオン化傾向とは?(イオン化傾向の基本定義と金属の性質について詳しい解説)
理系ラボ:イオン化傾向とは(覚え方・電池・金属と腐食・大きさの表)(語呂合わせや実践的な応用例の解説)
三重県:耐酸性を向上した萬古焼釉薬の開発(陶磁器釉薬における重金属溶出と耐酸性向上に関する研究報告)